- Autora Alex Aldridge [email protected].
- Public 2023-12-17 13:34.
- Última modificació 2025-06-01 07:36.
Diferència clau: metà vs etan
El metà i l'etan són els membres més petits de la família dels alcans. Les fórmules moleculars d'aquests dos compostos orgànics són CH4 i C2H6 respectivament. La diferència clau entre el metà i l'etan és la seva estructura química; una molècula d'etan es pot considerar com dos grups metil units com un dímer de grups metil. Les altres diferències químiques i físiques sorgeixen principalment a causa d'aquesta diferència estructural.
Què és el metà?
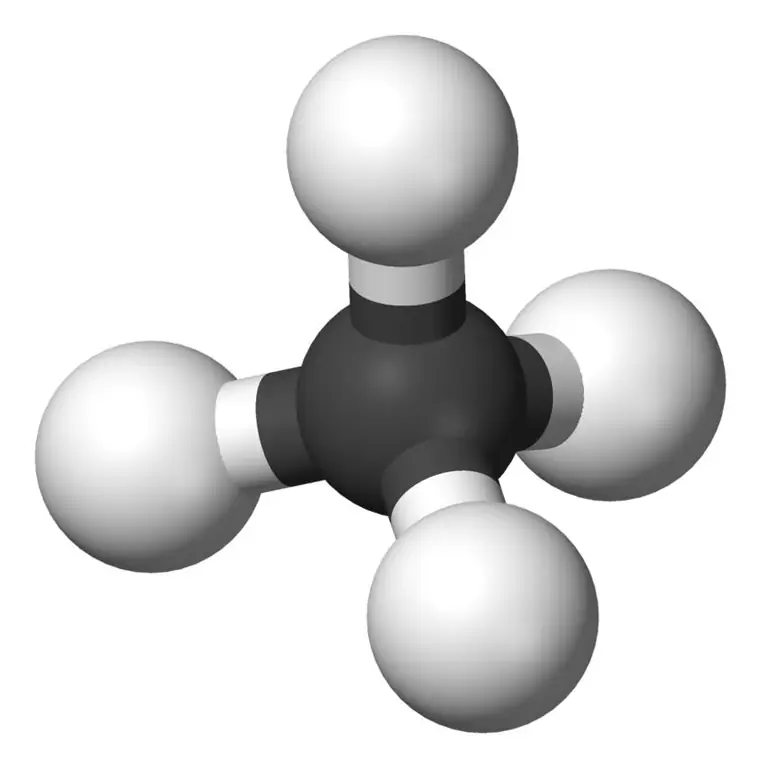
El metà és el membre més petit de la família dels alcans amb la fórmula química CH4(quatre àtoms d'hidrogen estan units a un àtom de carboni). Es considera el principal component del gas natural. El metà és un gas incolor, inodor i insípid; també conegut com carbà, gas de pantà, gas natural, tetrahidrur de carboni i carbur d'hidrogen. Es pot encendre fàcilment i el seu vapor és més lleuger que l'aire.
El metà es troba naturalment sota terra i sota el fons del mar. El metà atmosfèric es considera un gas d'efecte hivernacle. El metà es descompon en CH3- amb aigua a l'atmosfera.
Què és Ethane?
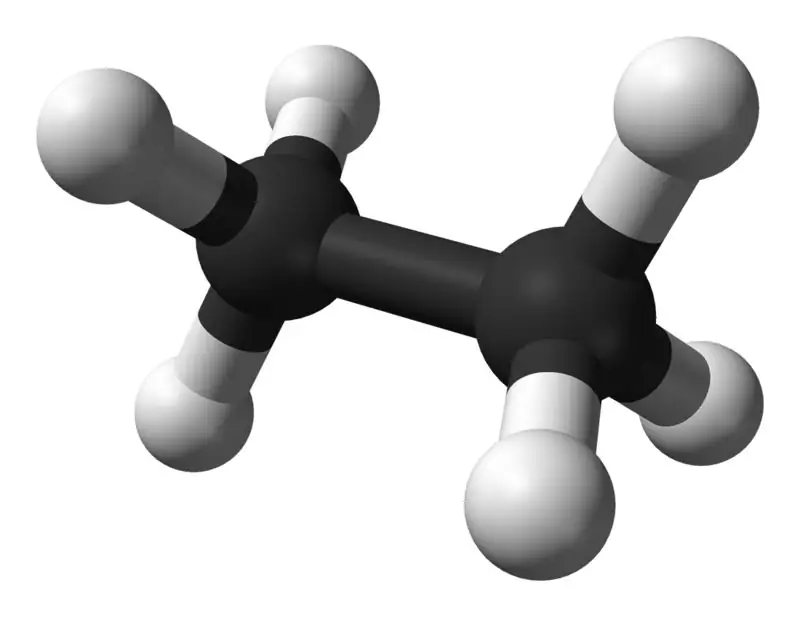
L'etan és un compost gasós incolor i inodor a temperatura i pressió estàndard. La seva fórmula molecular i el seu pes molecular són C2H6 i 30,07 g·mol−1 respectivament. Està aïllat del gas natural, com a subproducte del procés de refinació del petroli. L'etan és molt important en la producció d'etilè.
Quina diferència hi ha entre el metà i l'etan?
Característiques del metà i l'etan
Estructura:
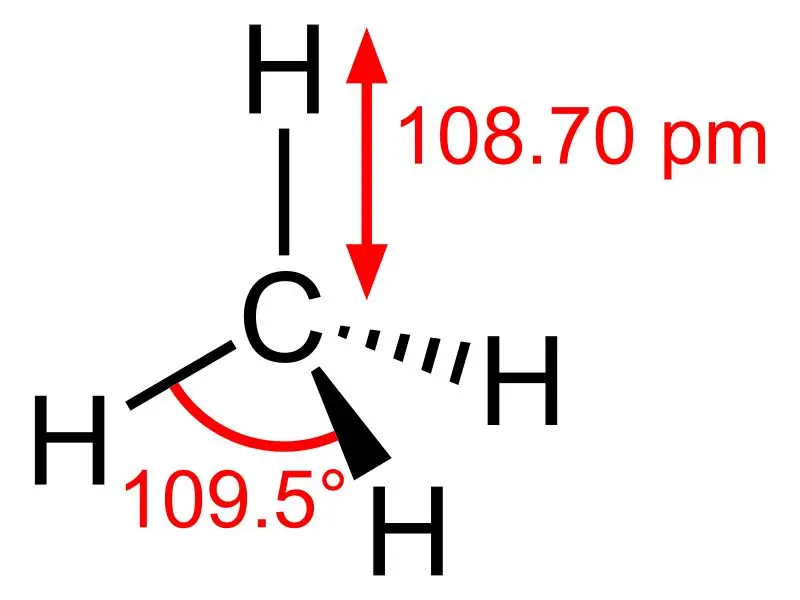
Metà: la fórmula molecular del metà és CH4, i és un exemple de molècula tetraèdrica amb quatre enllaços C-H equivalents (enllaços sigma). L'angle d'enllaç entre els àtoms H-C-H és 109,50 i tots els enllaços C-H són equivalents, i és igual a 108,70 pm.
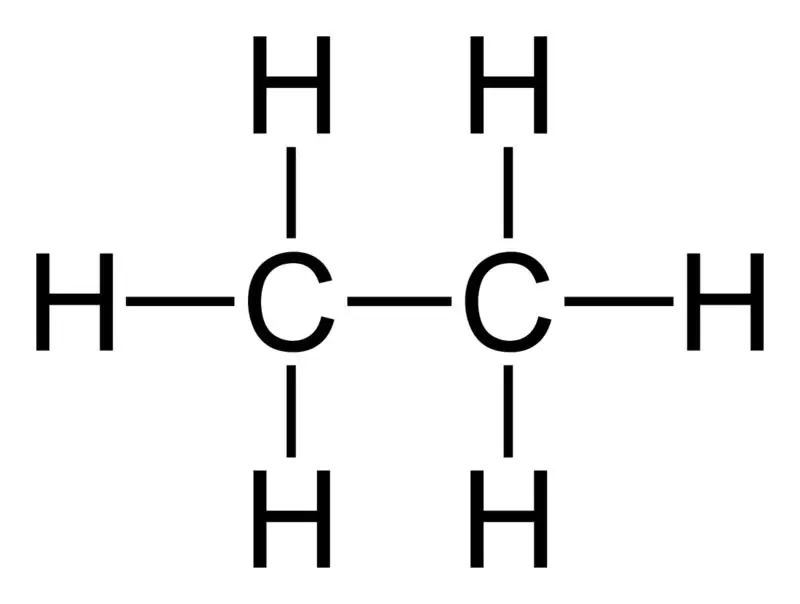
Età: la fórmula molecular de l'etan és C2H6,i és un hidrocarbur saturat ja que no conté múltiples enllaços.
Propietats químiques:
Metà:
Estabilitat: el metà és una molècula químicament molt estable que no reacciona amb KMnO4, K2Cr 2O7, H2SO4 o HNO 3 en condicions normals.
Combustió: en presència d'excés d'aire o d'oxigen, el metà crema amb una flama blau pàl·lid no lluminosa que produeix diòxid de carboni i aigua. És una reacció altament exotèrmica; per tant, s'utilitza com un excel·lent combustible. En presència d'aire o oxigen insuficient, es crema parcialment en gas monòxid de carboni (CO).
Reaccions de substitució: el metà mostra reaccions de substitució amb halògens. En aquestes reaccions, un o més àtoms d'hidrogen són substituïts per un nombre igual d'àtoms d'halogen i s'anomena "halogenació".” Reacciona amb clor (Cl) i brom (Br) en presència de la llum solar.
Reacció amb vapor: quan una barreja de metà i vapor es fa passar per un níquel escalfat (1000 K) recolzat sobre la superfície d'alúmina, pot produir hidrogen.
Piròlisi: quan el metà s'escalfa a uns 1300 K, es descompon en negre de carboni i hidrogen.
Ethane:
Reaccions: el gas etan (CH3CH3) reacciona amb el vapor de brom en presència de llum per formar bromoetano, (CH 3CH2Br) i bromur d'hidrogen (HBr). És una reacció de substitució; un àtom d'hidrogen a l'etan està substituït per un àtom de brom.
CH3CH3 + Br2 à CH3 CH2Br + HBr
Combustió: la combustió completa de l'etan produeix 1559,7 kJ/mol (51,9 kJ/g) de calor, diòxid de carboni i aigua.
2 C2H6 + 7 O2 → 4 CO 2 + 6 H2O + 3120 kJ
També pot ocórrer sense excés d'oxigen, produint una barreja de carboni amorf i monòxid de carboni.
2 C2H6 + 3 O2 → 4 C + 6 H 2O + energia
2 C2H6 + 5 O2 → 4 CO + 6 H 2O + energia
2 C2H6 + 4 O2 → 2 C + 2 CO + 6 H2O + energia, etc.
Definicions:
Reaccions de substitució: la reacció de substitució és una reacció química que implica el desplaçament d'un grup funcional en un compost químic i substituït per un altre grup funcional.
Usos:
Metà: el metà s'utilitza en molts processos químics industrials (com a combustible, gas natural, gas natural liquat) i es transporta com a fluid refrigerat.
Età: l'etan s'utilitza com a combustible per a motors i com a refrigerant per a un sistema de temperatura extremadament baixa. S'envia en cilindres d'acer com a gas liquat sota la seva pròpia pressió de vapor.






